En ámbito de la química, a la mezcla se les denomina con toda propiedad "sistemas dispersos" considerando que una o mas sustancias se encuentran, por decirlos así, esparcidas o disueltas en otra. mayor proporción se le denomina fase dispersora y a la otra u otras, fase dispersa.
otro tipo de sistema disperso son los coloides, donde la fase dispersa tiene un grado muy alto de división y las partículas solamente son visibles con microscopios especiales.
En caso de que ambas fases son liquidas, se llaman emulsión; pero si la fase dispensarte es liquida y la dispersa es solida, se llama suspensión.
Disoluciones, coloides y suspensiones.
Como ya conoces el tema anteriores, las mezclas o sistemas dispersos son de diversos tipos y no tienen las mismas características, por ejemplo, el tamaño de las partículas de las fase dispersa, pues de el dependen muchas de sus propiedades y aplicaciones.
Características de las disoluciones:
Son mezclas homogéneas cuyas partículas, pertenecientes a la fase dispersa, son cercanas al tamaño molecular de la fase dispersora, por eso las disoluciones se conocen también como soluciones verdaderas.
En una disolución, la fase dispersa se llama soluto y la parte dispersora solvente (disolventes).
Coligativas entre ellas se encuentran la disminución de la presión de vapor del solvente, disminución del punto de congelación, aumento del punto de ebullición la presión osmótica de la solución.
Anticongelante que consiste en una solución de etilenglicol, que al añadirse a, agua provoca un aumento del punto de ebullición y una disminución del punto de congelación, con lo cual el funcionamiento del vehículo soporta algunas condiciones extremas de calor o frió sin dañarse.
Ósmosis
El fenómeno de la ósmosis deriva de la evolución de los sistemas unicelulares, que desarrollaron una membrana que les permitió un eficaz intercambio de material con los alrededores. el fisiólogo y físico francés HENRI DUTROCHET ( 1776- 1847) descubrió el fenómeno ósmosis en 1828.
La relación existente entre estas variables se expresa por medio de las siguientes ecuaciones:
nV=nRT
- n= presión osmótica en atmósfera(atm)
- V=volumen de la solución en litros(L)
- n=numero de moles de solución
- T= temperatura absoluta del sistema en kelvin (K)
- R= constante universal de los gases ( 0.082 L-atm/K-mol)
Disoluciones isotónicas
las soluciones isotónicas son aquellas que poseen una cantidad similar de sales disueltas y por ellos mismo poseen igual concentración. las células se encuentran bañadas por un medio acuoso llamado liquido tisular y requieren permanecer en equilibrio osmótico con el para poder subsistir, de este modo permiten o impiden el paso de agua según sea necesario.
Si por alguna circunstancia el liquido tisulares volviera altamente concentrado( solución hipertonica), el agua tendería a salirse de la célula y pronto colapsaría.
Características de los coloides
el nombre coloides proviene del griego rolas, que significa " que puede pegarse", y hace referencia a la propiedad que tienen los coloides de formar coágulos de forma espontanea.
Los sistemas coloides están presentes en la vida diaria: en la higiene personal: jabones, champú, pasta dental, crema de afeitar y cosméticos; en el consumo de alimentos: leche, mantequilla, cremas vegetales y mermelada de frutas; camino de la escuela los puedes encontrar en la neblina y en algunos efectos en el cielo que le hacen tener diversos colores.
ROBERT BROWN: hizo el movimiento browniano surgió en una observación de índole biológica.
Otra forma de clasificar a los coloides- y tal vez la mas utilizada- es ubicarlos como liofilos o liofobos, según tengan respectivamente, afinidad o aversión por el medio dispensarte.
Diálisis
El proceso de diálisis se entiende como mayor facilidad si se tiene presente que las partículas coloidales presentan un tamaño tal que les impide pasar a través de los poros de una membrana semipermeable. por esa razón una dispersión coloidal no puede ser purificada por filtacion, pero si puede ser dializada colocandola en bolsa semipermeable con agua pura en el exterior.
La diálisis es utilizada con frecuencia en el tratamiento de los enfermos con padecimientos renales crónicos, y dado que lo que se dializa es la sangre y el proceso se conoce como hemodialisis.
Floculación
es un proceso espontaneo que ocurre entre las partículas coloidales (flocs) que tienden a unirse entre si y alcanzar un mayor tamaño. la floculación provoca, entre otras cosas, que el sistema coloidal se vaya enturbiando paulatinamente y que si las partículas coloidales alcanzan el tamaño suficiente tiendan a sedimentarse , con lo cual se separan del medio dispersor.
Superficie de absorción
La viabilidad de una industria esta determinada por su aprovechamiento, como en la catálisis o bien destructivamente como en la corrosión; ambos procesos tienen lugar en las superficies solidas.
Por otra parte, en los sistemas biológicos la transferencia de materiales hacia el interior y hacia el exterior de las células tiene lugar mediante absorción sobre la membrana celular, penetración en esta y desorción en la superficie es el adsorbato y el material sobre el cual lo hace es el absorbente.
4 tema: Unidades de concentración de los sistemas dispersos
Los métodos de separación de una mezcla se basan en las diferentes propiedades físicas de sus componentes; algunas de ellas son: punto de ebullición, punto de fusión, densidad, presión de vapor entre otras.
Filtración
Se utiliza para separar sólidos no solubles con el liquido que funciona como solvente. En los medios porosos que sirven como filtro están: filtro, algodón, papel filtro, porcelana porosa, lana de vidrio, arena carbón, entre otras.
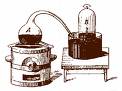
Destilación
Es un medio que toma como base los diferentes puntos de ebullición de los componentes líquidos de una mezcla y la vaporización y la condensación.
destilación simple: es una técnica aplicada cuando los líquidos constituyentes de la mezcla hierven a una temperatura menor a 150 C y a la presión atmosférica normal; pero es necesario que las sustancias tengan una diferencia al menos de 25 C en sus puntos de ebullición.
destilación al vació: se utiliza con sustancias que poseen puntos de ebullición mayores a 150 C, como la destilación del crudo, el se destila a una temperatura cercana a 400 C.
destilación fraccionada: se recomienda si la diferencia en los puntos de ebullición entre dos sustancias es menor a 25 C. la destilación fraccionada se encuentra en la separación de los diversos componentes del petroleo como como lubricante, gas, queroseno, gasolina e hidrocarburos, entre otros. cada uno de ellos se va separando de los otros según el grado de ebullición separado de los otros según el grado de ebullición que presentan.
destilación por arrastre de vapor: se emplea para sustancias que son poco solubles en agua y que poseen alto punto de ebullición.
Cromatografía
La palabra cromatografia proviene del griego kbroma, "color" y grapbein, "escritura" y es un método muy interesante y vistoso utilizado en la separación de mezclas.
dos fases una estacionaria- se puede utilizar un medio poroso como papel, una placa cubierta de una sustancia especial o una columna rellena de material optimo, que permita el movimiento de la mezcla a través de este- y la otra móvil- si es necesario puede disolverse en un solvente apropiado.
Cristalización
Se utiliza cuando se requiere obtener una sustancia cristalina con alto grado de pureza o se necesita separar el solvente del solido cristalino disuelto.
Algunos medicamentos como la cimetidina- utilizada en el tratamiento de ulceras estomacales y reflujo gástrico debido a niveles muy altos de acidez- son fabricados mediante un proceso de cristalización diferenciada, en el que la sustancia se disuelve y evapora en repetidas ocasiones hasta obtener cristales con alto grado de pureza, que permitan su administración en los pacientes.
Centrifugado
Es el método apropiado cuando se tiene un solido insoluble que se encuentra disperso en un liquido de alta densidad. La centrifugación se utiliza en los análisis de sangre.Otro aplicación de la centrifugación es la limpieza o reciclado de diversos aceites como los usados en el motor de los autos. Algunas empresas se dedican a recibir el aceite "sucio", lo someten al proceso de cetrifugación y lo dejan listo para volver a usarse.
Decantación
Los vinos, antes de ser servidos ,son tratados mediante un proceso de decantación. Es un método de separación de mezclas que sirven para separar dos líquidos no miscibles, como es el caso del agua y el aceite.
Sustancias floculantes: que producen la aglomeración de las partículas que aun permanecen en suspensión, lo que ayuda a forzar su sedimentación.
Sublimación
Algunas sustancias como el yodo o la naftalina, transitan del estado solido al gaseoso cuando sufre un aumento de temperatura.
Tamizado
Algunos sólidos, como la arena utilizada en la construcción, contienen partículas de tamaño diverso. mediante el tamizado es posible efectuar una separación conveniente cuando es necesario tener un solo tamaño de partículas.
magnetismo
Un método de rápido y efectivo para la separación del hierro recurre a electroimanes suspendidos mediante un mecanismo que se mueve por el patio donde se concentra la chatarra. El electroiman atrae a los materiales ferrosos y los depósitos en el horno donde se procesaran.
5 tema: ácidos y bases
El termino concentración se refiere a la cantidad de soluto presente en un volumen de solución, y puede expresarse de forma cualitativa o cuantitativa.
tipos de concentración
Cualitativamente, las soluciones pueden ser de cuatro tipos: diluidas, concentradas, saturadas y sobresaturadas.
soluciones diluidas: contienen una cantidad relativamente pequeña de soluto disuelto en una cantidad considerable de solución, por ejemplo una solución preparada con un poco de azúcar y varios litros de agua.
soluciones concentradas: son aquellas que poseen una cantidad relativamente grande de soluto en un volumen de solución determinado. Ejemplo una gran cantidad de azúcar y el mismo volumen de agua.
soluciones saturadas: a una temperatura determinada , un solvente puede admitir una cantidad máxima de soluto disuelto.
soluciones sobresaturadas: son aquellas que contienen mayor concentración de soluto que una solución saturada a una temperatura dada. Cuando una solución saturada se calienta puede aceptar mas soluto disuelto.
modos de calcular la concentración de una disolución
La concentración puede expresarse de diversas maneras: concentración porcentual, moralidad, partes por millón, normalidad y fracción molar.
concentración porcentual
Se calcula dividiendo la masa de soluto entre la masa de la solución y multiplicado el resultado por 100.
C= masa de soluto x 100 / masa de solución.
Puesto que la masa de la solución corresponde a la suma de la masa de soluto y la masa del solvente, la expresión anterior puede escribirse así:
C= masa de soluto / masa de soluto + masa de solvente x 100
ejemplo:
determina la concentración en términos porcentuales de una solución que se prepara disolviendo 2.5g de KNO3 en 250g de H2O.
SOLUCIÓN
datos:
- msoluto=2.5g
- msolucion= 2.5g+250g= 252.5g
- c= x (%)
entonces:
C= 2.5g KNO3 / 2.5g+ 250g H2O x 100 de KNO3 = 0.99% de KNO3
Molaridad
La moralidad (M) de una solución se define como la cantidad de moles de soluto por litros de solución.
1 formula: M= n / V
los moles de una sustancia se obtienen dividiendo la masa de la muestra entre la masa molar o masa atómica, según sea un compuesto o un elemento respectivamente.
2 formula: M= n / (MM)
5 tema: Ácidos y bases
La descripción de alguna propiedades como el saber agrio de los ácidos y la textura jabonosa de los alcalinos o bases, pero no se conocían las razones que, a nivel molecular, distinguían a un ácido de una base.
propiedades químicas de los ácidos:
- tiene sabor agrio.
- colorean de rojo el papel de tornasol.
- sus disoluciones conducen la electricidad
propiedades químicas de las bases:
- tienen un sabor amargo característico.
- al igual que los ácido, en disolución acuosa conducen la electricidad.
- colorean de azul el papel de tornasol.
- reaccionan con los ácidos para formar una sal mas agua.
Los ácidos contaban en su formula con los hidrógeno como elemento característico y las bases incluían grupos hidroxilo. En la actualidad, se afirman que los ácidos son donadores de protones, mientras que las bases son aceptoras de protones.
Teorema de Arrhenius
Investigación científica a los efectos de la adición de cierto solutos al agua. "electrolitos" indicando con ello que eran capaces de conducir la electricidad al fundirse i al ser disueltas en agua.
- Los ácidos producen iones hidrógeno ( H+) en soluciones acuosa.
- las bases, en condiciones similares , producen iones hidróxidos y oxidrilo.
Teorema de Bronsted- Lowry
Dado que es la ultima se limitaba a las soluciones acuosas y se han encontrado reacciones ácido-base que se verifican en fase gaseosa o en solventes distintos al agua, como el caso del amoniaco y el cloruro de hidrógeno, que reaccionan en fase gaseosa para formar una sal, el cloruro de amonio:
NH3(g) + HCl(g) --> NH4Cl(s)
- un ácido es cualquier especie química que puede donar un pronto (iones hidrógeno H+) es decir,un átomo de hidrógeno sin su electrón.
- una base, de acuerdo a esta postura, es una especie capas de aceptar un pronto( iones hidrógeno H).
- una reacción ácido - base sera aquella en la que el ácido transfiere un pronto a una base.
HA-->H + A-
Cuando el ácido sulfúrico (H2SO4) se disuelve en agua, se disocia casi por completo, y se considera por tanto un ácido fuerte. La flecha de reacción que se digiere exclusivamente a ala derecha tiene ese significado:
H2SO4 --> 2H + SO42-
un ácido débil (Ha) cede sus iones hidrógeno (H+) con dificultad y se disocia muy poco en disolución.
Ha --> <-- H + a
HC2H3O2 --> <--- H + S2H3O2
B + H + --> B+
Una base debil (b) acepta con mucha dificultad los H+ y recibe, por la misma razón, unos cuantos protones:
b+H --> <-- + bH
Formulo una definición que plantea:
- un ácido es un ion o molécula aceptora de un par de los electrones.
- una base es un ion o molécula donante de un par de electrones.
cuando un ácido y una base se mezclan las propiedades de ambos se anulan o bien, disminuyen considerablemente, a esta reacción se le conoce como "neutralzación".
Grados de acidez o de basicidad de la solución
La acides o la alcalinidad de una sustancia esta en función de la concentración de iones y de hidronio que se obtiene al disolverla en agua. Propuso una alternativa para expresar la concentración de H3O+. El sugirió que, en lugar de usar números de forma decimal o exponencial, que empleada una transformación logaritmica de la concentración moral de protones, a la que se le llamo PH, y la definió como el negativo del antilogaritmo en base 10 de la concentración de iones hidronio.